Doença celíaca
Doença celíaca | |
|---|---|
 Biópsia do intestino delgado onde a doença celíaca se manifesta por deformações nas vilosidades, hiperplasia e infiltração de linfócitos nas criptas. | |
Especialidade | Gastroenterologia, medicina interna |
| Sintomas | Assintomática ou não específicos, distensão abdominal, diarreia, obstipação, má-absorção intestinal, perda de peso, dermatite herpetiforme[1][2] |
| Complicações | Anemia por deficiência de ferro, osteoporose, infertilidade, cancros, distúrbios neurológicos, outras doenças autoimunes[3][4][5][6][7] |
| Início habitual | Em qualquer idade[1][8] |
| Duração | Vitalícia[6] |
| Causas | Reação ao glúten[9] |
| Método de diagnóstico | Antecedentes familiares, exames aos anticorpos, biópsia intestinal, exames genéticos, resposta à privação de glúten[10][11][10] |
Condições semelhantes | Doença inflamatória intestinal, parasitas intestinais, síndrome do cólon irritável, fibrose cística[12] |
| Tratamento | Dieta sem glúten[13] |
| Frequência | ~1 em 135[14] |
| Classificação e recursos externos | |
CID-10 | K90.0 |
CID-9 | 579.0 |
OMIM | 212750 |
DiseasesDB | 2922 |
MedlinePlus | 000233 |
eMedicine | med/308 ped/2146 radio/652 |
MeSH | D002446, D002446 |
Doença celíaca é uma doença autoimune crónica do intestino delgado causada por uma reação ao glúten em pessoas com predisposição genética.[10] Os sintomas clássicos incluem problemas gastrointestinais como diarreia crónica, distensão abdominal, má-absorção intestinal e perda de apetite. Em crianças, pode ocorrer atraso no crescimento que geralmente se inicia entre os seis meses e dois anos de idade.[1] Os sintomas não clássicos são mais comuns, especialmente em pessoas com mais de dois anos.[8][15][16][17] A pessoa pode não manifestar sintomas gastrointestinais ou manifestar apenas sintomas gastrointestinais ligeiros, podem ocorrer sintomas em qualquer parte do corpo, ou não haver sintomas visíveis de todo.[1] Embora a doença celíaca seja geralmente diagnosticada durante a infância,[8][6] pode aparecer em qualquer idade.[1][8] A doença está associada a outras doenças autoimunes, como diabetes mellitus tipo 1 e tiroidite, entre outras.[6]
A doença celíaca é causada por uma reação do organismo ao glúten, um conjunto de proteínas presentes no trigo e em outros cereais como a cevada ou centeio.[9][18][19] A aveia em quantidades moderadas é geralmente tolerada, dependendo da variedade[18][20] e desde que não esteja contaminada com outros cereais com glúten.[18][21] Ao ser exposto ao glúten, o sistema imunitário desencadeia uma resposta anormal, produzindo uma série de anticorpos que podem afetar diversos órgãos.[4][22] No intestino delgado, esta resposta imunitária provoca uma reação inflamatória que faz diminuir as vilosidades intestinais.[10][11] Isto afeta a absorção de nutrientes pelo intestino, o que em muitos casos causa anemia.[10][19]
O diagnóstico é geralmente feito com análises aos anticorpos do sangue e uma biópsia do intestino, podendo ser apoiado por exames genéticos.[10] No entanto, o diagnóstico nem sempre é conclusivo.[23] Em muitos celíacos, o exame aos anticorpos é negativo[24][25] e muitos indivíduos apresentam apenas ligeiras alterações intestinais com vilosidades normais.[16][26] Em alguns casos, o diagnóstico pode levar anos para ser confirmado, mesmo que as pessoas sejam examinadas e manifestem sintomas pronunciados.[27] Com o avanço das técnicas de rastreio, é cada vez mais comum o diagnóstico de doença celíaca entre pessoas assintomáticas.[28] No entanto, não há ainda evidências conclusivas que apoiem a eficácia do rastreio sistemático.[29] Embora a doença seja causada por uma intolerância permanente às proteínas do trigo, não se trata de uma forma de alergia ao trigo.[10]
O único tratamento eficaz conhecido é seguir uma dieta sem glúten durante toda a vida. A ausência de glúten permite a reparação das mucosas do intestino, alivia os sintomas e diminui o risco de complicações na maioria das pessoas.[13] Quando a doença não é tratada, pode levar ao aparecimento de cancros como o linfoma intestinal e a um ligeiro aumento do risco de morte prematura.[3] A frequência da doença varia entre as diferentes regiões do mundo, desde 1 em cada 300 pessoas até 1 em cada 40 pessoas. A média é de entre 1 em cada 100-170 pessoas.[14] Nos países desenvolvidos, estima-se que 80% dos casos não cheguem a ser diagnosticados, geralmente devido à ausência de sintomas gastrointestinais e ao pouco conhecimento da doença entre a população.[5][30] A doença celíaca é ligeiramente mais comum entre mulheres do que em homens.[31] O termo "celíaco" tem origem no grego κοιλιακός (koiliakós, "abdominal"), tendo sido introduzido na linguagem contemporânea durante o século XIX numa tradução do que é geralmente considerada a primeira descrição da doença por Areteu da Capadócia.[32][33]
Índice
1 Sinais e sintomas
1.1 Gastrointestinais
1.2 Relacionados com a má absorção
1.3 Outros sintomas
2 Causas
2.1 Outros cereais
2.2 Modificadores de risco
3 Diagnóstico
3.1 Exames sanguíneos
3.2 Endoscopia
3.3 Patologia
3.4 Outros exames de diagnóstico
4 Fisiopatologia
4.1 Genética
4.2 Prolaminas
4.3 Transglutaminase tecidular
4.4 Atrofia das vilosidades e má absorção
5 Rastreio
6 Tratamento
6.1 Dieta isenta de glúten
6.2 Doença refratária
7 Epidemiologia
8 Sociedade e cultura
8.1 Igreja cristã e eucaristia
8.1.1 Posição da igreja católica romana
8.2 Pessach
9 Investigação
10 História
11 Notas
12 Ligações externas
Sinais e sintomas |
A doença celíaca grave manifesta-se através de sintomas característicos, como fezes claras, fétidas, acompanhadas de gordura e flutuantes (esteatorreia), perda de peso ou incapacidade de ganhar peso (no caso de crianças). As pessoas com doença moderada podem manifestar sintomas muito mais subtis e em outros órgãos para além do próprio intestino. É também possível ter doença celíaca sem manifestar quaisquer sintomas.[34] Muitos adultos com doença leve apenas apresentam fadiga ou anemia.[28]
Gastrointestinais |
A diarreia característica da doença celíaca é clara, volumosa e anormalmente fétida. São também comuns cãibras e dores abdominais, sensação de barriga inchada com distensão abdominal (que se pensa ser devida à fermentação de gases intestinais) e úlceras na boca.[35] À medida que aumentam as lesões no intestino é possível que se desenvolva intolerância à lactose de grau variável.[34] Em muitos casos, os sintomas são inicialmente atribuídos à síndrome do intestino irritável (SII), só sendo mais tarde confirmada a doença celíaca. Uma pequena percentagem dos casos de pessoas com sintomas de SII tem doença celíaca, sendo recomendado o rastreio para quem manifeste sintomas de SII.[36]
A doença celíaca aumenta o risco de adenocarcinoma e linfoma do intestino delgado (linfoma de células T associado a enteropatia (EATL) ou outros linfomas não Hodgkin).[37] Este risco é também acrescido em parentes em primeiro grau e ainda não é claro se após a adesão a uma dieta isenta de glúten este risco volta ou não aos valores normais.[38] Caso a doença não seja tratada após um longo intervalo de tempo é possível que surjam outras complicações, como jejunite ulcerativa (formação de úlceras no intestino delgado) e estreitamento e obstrução do intestino devido à cicatrização).[39]
Relacionados com a má absorção |
As alterações no intestino diminuem a sua capacidade de absorver nutrientes, sais minerais e as vitaminas lipossolúveis A, D, E e K.[34][40]
- A incapacidade em absorver hidratos de carbono e gorduras pode provocar perda de peso (ou, em crianças, atraso no desenvolvimento fisiológico), fadiga ou falta de energia.
- A anemia pode desenvolver-se de várias formas: a má absorção de ferro pode provocar anemia por deficiência de ferro, enquanto que a má absorção de ácido fólico e vitamina B12 pode provocar anemia megaloblástica.
- A má absorção de cálcio e vitamina D (e o hiperparatiroidismo compensatório secundário) podem provocar osteopenia (diminuição da quantidade de mineral no osso) ou osteoporose (enfraquecimento do osso e risco de fraturação).
- A má absorção de selénio, em conjugação com o baixo teor de selénio em muitos dos alimentos isentos de glúten, agrava o risco de hiposselenemia,[41]
- Estão também associadas à doença deficiências em cobre e zinco.[41]
- Uma pequena percentagem dos celíacos apresenta coagulação anormal devido à deficiência de vitamina K, o que agrava o risco de hemorragias.
- A doença celíaca está também associada ao crescimento excessivo das bactérias do intestino delgado, o que pode agravar ainda mais a má absorção ou causar má absorção mesmo com o tratamento.[42]
Outros sintomas |
A doença celíaca tem sido associada a diversas condições. Em muitos casos, não é ainda claro se a causa destas condições é a própria doença induzida pelo glúten ou se têm todas origem numa predisposição comum.
- A deficiência de imunoglobulina A ocorre em 2,3% das pessoas com doença celíaca e, por sua vez, esta condição agrava em dez vezes o risco de vir a ter doença celíaca. Esta condição também agrava o risco de infeções e de doenças autoimunes.[43]
Dermatite herpetiforme, uma condição cutânea comichosa que tem sido associada à enzima transglutaminase presente na pele. Manifesta-se por alterações no intestino delgado idênticas às da doença celíaca e pode responder à remoção de glúten, mesmo na inexistência de sintomas gastrointestinais.[44][45]
- Durante a infância, pode ocorrer atraso no crescimento e/ou na puberdade, mesmo perante a inexistência de sintomas intestinais óbvios ou desnutrição grave. O diagnóstico de atraso no desenvolvimento muitas vezes inclui o rastreio de doença celíaca.[34]
- Podem ocorrer complicações na gravidez devido à doença celíaca, entre as quais aborto espontâneo, atraso no desenvolvimento do feto, parto pré-termo ou baixo peso à nascença.[46]
Hipoesplenismo, ou baço pequeno e pouco ativo,[47] condição que ocorre em cerca de um terço dos casos e pode predispor a pessoa para uma infeção, dado o papel do baço na proteção contra bactérias.[34]
Testes de função hepática fora do normal.[34]
A doença celíaca está ainda associada a diversas outras condições médicas, muitas das quais são doenças autoimunes: diabetes mellitus tipo 1, hipotiroidismo, cirrose biliar primária e colite microscópica.[22]
Uma associação mais controversa está relacionada com um grupo de doenças nas quais são detetados anticorpos anti-gliadina, mas não é possível demonstrar qualquer doença do intestino delgado. Por vezes estas condições melhoram após remover o glúten da dieta. Entre elas estão a ataxia cerebelar, neuropatia periférica, esquizofrenia e autismo.[48]
Causas |
A doença celíaca é causada por uma reação à gliadina, uma prolamina (proteína do glúten) presente no trigo, e a proteínas semelhantes presentes na tribo das Triticeae (que inclui outros cereais comuns como a cevada e o centeio).[34]
Outros cereais |

A doença celíaca é uma reação autoimune do organismo a uma proteína do glúten presente principalmente no trigo. Uma dieta isenta de glúten faz regredir os sintomas da doença.
Algumas subespécies de trigo, como a espelta, e algumas espécies relacionadas, como a cevada, o centeio ou o triticale, também induzem sintomas da doença celíaca.[49] Uma pequena minoria das pessoas com a doença também reagem à aveia.[34] É provável que a aveia induza sintomas devido à contaminação cruzada com outros cereais nas zonas de cultivo ou nos canais de distribuição, pelo que o seu consumo geralmente não é recomendado a celíacos. No entanto, algumas empresas garantem a pureza da aveia, pelo que pode continuar a ser consumida por este meio.[49]
O consumo de outros cereais, como o milho, painço, sorgo, teff, arroz ou arroz selvagem, é seguro para celíacos, assim como não cereais como o amaranto, quinoa ou o trigo mourisco.[49][50] Outros alimentos não cereais, como as batatas ou as bananas, não contêm glúten e não desencadeiam sintomas.[49]
Modificadores de risco |
Existem várias teorias sobre o que determina se um indivíduo geneticamente predisposto desenvolve ou não doença celíaca. Entre as principais teorias estão a infeção por rotavírus[51] ou adenovírus intestinal humano.[52] Alguma investigação tem sugerido que fumar oferece alguma proteção contra o aparecimento da doença na fase adulta.[53]
As pessoas expostas ao trigo, cevada ou centeio antes de terem a flora intestinal completamente desenvolvida (nos três meses posteriores ao nascimento) apresentam um risco cinco vezes superior de desenvolver doença celíaca em comparação com as pessoas expostas apenas quatro a seis meses após o nascimento. Os que são expostos após os seis meses apresentam um risco ligeiramente superior em comparação com aqueles expostos entre os quatro e seis meses.[54] A introdução precoce de cereais na vida das pessoas oferece proteção contra as alergias a cereais.[55] A amamentação pode também oferecer proteção em relação ao desenvolvimento da doença. Amamentar durante a introdução do glúten na dieta e aumentar a duração do período de amamentação estão associados a um menor risco de vir a desenvolver doença celíaca, embora ainda não seja claro se os benefícios são permanentes ou se apenas atrasa os sintomas.[56] Entre outros fatores que podem desencadear sintomas estão as cirurgias, a gravidez, infeções e stresse emocional.[57]
Diagnóstico |
Existem diversos exames que podem ser usados como meio de diagnóstico, sendo a realização determinada em função da intensidade dos sintomas. No entanto, todos os exames perdem utilidade caso a pessoa já se encontre a fazer uma dieta isenta de glúten. Após a remoção do glúten da dieta, as lesões no intestino delgado começam a curar no prazo de poucas semanas e a quantidade de anticorpos diminui no prazo de alguns meses. Para o correto diagnóstico destas pessoas, pode ser necessária a ingestão de alguns produtos com glúten numa das refeições diárias e ao longo de seis semanas.[22]
A combinação das observações numa regra de predição para orientar o uso de uma biópsia endoscópica apresenta uma sensibilidade de 100% (identificaria todos os casos) numa população de indivíduos com elevado índice de suspeita para a doença celíaca, com especificidade de 61% (39% de falsos positivos). A regra de predição recomenda que as pessoas com sintomas de elevado risco ou serologia positiva se devem submeter a uma biópsia endoscópica da segunda parte do duodeno. Os sintomas de elevado risco são a perda de peso, anemia (hemoglobina inferior a 120 g/l em mulheres ou 130 g/l em homens) ou diarreia (mais de três fezes líquidas por dia).[58]
Exames sanguíneos |
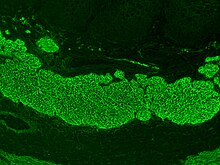
Padrão imunofluorescente de anticorpos endomisiais numa amostra de tecido de esófago animal.
Os exames sanguíneos serológicos são a primeira linha de investigação para confirmar um diagnóstico de doença celíaca. Os anticorpos endomisiais do tipo imunoglobulina A (IgA) são capazes de detetar a doença com uma sensibilidade e especificidade de 90% e 99%, respetivamente.[59] A serologia de anticorpos anti-tTG foi inicialmente reportada como tendo maior sensibilidade (99%) e especificidade (90%). No entanto, atualmente pensa-se que tenha características semelhantes aos anticorpos anti-endomisiais.[59] Os exames anti-tTG atuais têm por base uma proteína recombinante humana como antígeno.[60] O exame tTG é geralmente o primeiro a ser realizado por ser o mais simples de executar. Um resultado ambíguo de tTG é geralmente seguido por um exame de anticorpos endomisiais.[22]
Devido às profundas implicações que um diagnóstico de doença celíaca representa, as orientações profissionais recomendam que um exame sanguíneo positivo seja mesmo assim seguido por uma esofagogastroduodenoscopia/endoscopia e biópsia. Caso continue a existir suspeita clínica após um exame serológico negativo, pode também ser feita uma recomendação de endoscopia e biópsia ao duodeno, devido à taxa de 1% de falsos negativos que os exames apresentam. Por este motivo, a biópsia continua a ser considerada o padrão-ouro no diagnóstico de doença celíaca.[39][22][61] As orientações recomendam também que seja realizado em paralelo o exame da quantidade de IgA no soro, já que os celíacos com insuficiência de IgA podem ser incapazes de produzir os anticorpos em que os outros exames se baseiam, dando origem a falsos negativos.[22][62]
No passado eram medidos três outros anticorpos: os anticorpos anti-reticulina (ARA), anti-gliadina e anti-endomísio.[63] No entanto, o exame aos anticorpos ARA não é suficientemente preciso para diagnósticos de rotina.[64] A serologia pode ser pouco fidedigna em crianças mais novas, embora o exame aos anticorpos anti-gliadina seja ligeiramente mais fidedigno do que outros exames em crianças com idade inferior a cinco anos.[63]
Os exames serológicos usam a técnica de imunofluorescência indireta (reticulina, gliadina e endomísio) ou o método ELISA (gliadina ou tTG).[65] Os exames para a presença de anticorpos e os exames para a presença de antígeno leucocitário humano (HLA) têm precisão equivalente;[66] no entanto, atualmente não é recomendada a utilização de HLA no diagnóstico de doença celíaca.[22]
Endoscopia |

Imagem do duodeno de uma pessoa com doença celíaca obtida por endoscopia, na qual se pode observar pregas serrilhadas e a aparência semelhante a lama seca da mucosa.
Geralmente é realizada uma biópsia do duodeno ou do jejuno. São recolhidas entre quatro e oito amostras de tecido, já que as áreas podem não ser afetadas por igual e se a amostra for recolhida a partir de uma área saudável pode dar origem a falsos negativos.[39]
Na maior parte das pessoas com doença celíaca, o intestino delgado apresenta-se normal durante uma endoscopia. No entanto, existem cinco observações endoscópicas que sugerem doença celíaca: pregas mucosas serrilhadas, padrão em mosaico da mucosa (semelhante ao padrão de lama seca), proeminência dos vasos sanguíneos da submucosa e padrão nodular da mucosa.[67]
Até à década de 1970, as biópsias eram realizadas com cápsulas de metal ligadas a um dispositivo de sucção. A cápsula era engolida e transitava até ao intestino delgado. Após ser confirmada a sua posição através de raio X, era aplicada sucção para recolher parte da parede intestinal para o interior da cápsula. Este método foi em grande parte substituído pela endoscopia de fibra ótica, com maior sensibilidade e menor taxa de erro.[68]
Patologia |
As alterações patológicas clássicas da doença celíaca no intestino delgado são categorizadas de acordo com a Classificação de Marsh:[69][70]
- Estádio 0: mucosa normal
- Estádio 1: infiltração linfocitária intraepitelial superior a 20 por cada 100 enterócitos
- Estádio 2: proliferação das criptas intestinais
- Estádio 3: atrofia parcial ou total das vilosidades intestinais e hipertrofia das criptas[71]
- Estádio 4: hipoplasia da constituição do intestino delgado

Estádios das alterações patológicas no intestino delgado de acordo com a Classificação de Marsh.
A classificação de Marsh, introduzida em 1992, foi posteriormente modificada em 1999 para seis estádios, tendo o estádio 3 sido dividido em três sub-estágios.[72] Os estudos posteriores demonstraram que este sistema nem sempre era fidedigno e que as alterações observadas na doença celíaca podiam ser descritas em um de três estágios — A, B1 e B2 — em que A representa a infiltração linfocitária com aparência das vilosidades normal e em que B1 e B2 descrevem a atrofia parcial ou total das vilosidades.[34][73]
Estas alterações geralmente melhoram ou são revertidas após a remoção do glúten da dieta. No entanto, a maior parte das orientações não recomenda repetir a biópsia a não ser que não se verifique a melhoria dos sintomas com a dieta.[39][61] Em alguns casos pode ser prescrita a ingestão temporária de glúten, seguida por biópsia, para confirmar ou refutar o diagnóstico. Uma biópsia e serologia normais após este teste podem indicar que o diagnóstico inicial foi incorreto.[39]
Outros exames de diagnóstico |
Durante o diagnóstico podem ser realizados outros exames para identificar complicações, como a deficiência de ferro (através de hemograma), deficiência de ácido fólico ou vitamina B12 e hipocalcemia (diminuição do nível de cálcio, geralmente devido à diminuição de vitamina D). Podem também ser realizados exames à função da tiroide juntamente com os exames sanguíneos de modo a identificar hipotiroidismo, o qual é mais comum entre celíacos.[40] A osteopenia e a osteoporose (diminuição da densidade mineral dos ossos) estão muitas vezes presentes em pessoas com a doença, pelo que durante o diagnóstico podem ser realizados exames para medição da densidade óssea para avaliar o risco de fraturas e a necessidade de medicação para proteção óssea, como a varredura por absorciometria bifotónica de raio X (DXA).[39][40]
Fisiopatologia |
Praticamente todas as pessoas com doença celíaca ou têm o alelo HLA-DQ2 ou, menos frequentemente, o alelo HLA-DQ8.[28] No entanto, cerca de 20-30% das pessoas sem a doença também herdaram um destes alelos.[66] Isto sugere que são necessários outros fatores para que a doença se desenvolva; isto é, que o alelo HLA é condição necessária, mas não suficiente, para desenvolver doença celíaca. Além disso, cerca de 5% das pessoas que desenvolvem a doença não apresenta os alelos HLA-DQ2 ou HLA-DQ8.[28]
Genética |
A vasta maioria das pessoas com doença celíaca têm um de dois tipos da proteína HLA-DQ.[66] Existem sete variantes HLA-DQ (DQ2 e DQ4 a DQ9). Mais de 95% das pessoas com doença celíaca têm a isoforma DQ2 ou DQ8, a qual é herdade entre a família. Estes genes aumentam o risco de doença celíaca porque os seus recetores ligam-se aos peptídeos de gliadina mais firmemente do que outras formas do recetor apresentador de antígeno. Assim, estas formas do recetor têm maior probabilidade de ativar os linfócitos T e dar início ao processo autoimune.[28]
A maior parte dos celíacos apresenta um haplotipo HLA-DQ2 de dois genes designado haplotipo DQ2.5. Este haplotipo é composto por dois alelos génicos, DQA1*0501 e DQB1*0201, os quais codificam as duas subunidades, DQ α5 e DQ β2. Na maior parte das pessoas, esta isoforma DQ2.5 é codificada por um de dois cromossomas 6 herdado dos pais (DQ2.5cis). A maioria dos celíacos herda apenas uma cópia deste haplotipo DQ2.5, enquanto os restantes herdam-no de ambos os pais. Estes últimos apresentam um risco particularmente elevado de doença celíaca e são mais suscetíveis a complicações graves.[74]
Algumas pessoas herdam o DQ2.5 de um dos pais e uma parte adicional do haplotipo do outro progenitor, o que aumenta o risco. Ainda que de forma menos comum, algumas pessoas herdam o alelo DQA1*05 de um dos pais e o DQB1*02 do outro (DQ2.5trans) (situação que se denomina "associação trans-haplotipo"). Estas pessoas apresentam risco idêntico de contrair a doença em relação àquelas com um único cromossoma 6 DQ2.5, embora neste caso a doença não tenha tendência a ser familiar. Entre os 6% de celíacos na Europa que não têm o DQ2.5 (cis ou trans) ou o DQ8 (codificado pelo haplotipo DQA1*03:DQB1*0302), 4% têm a isoforma DQ2.2 e os restantes 2% não têm nem o DQ2 nem o DQ8.[75]
A frequência destes genes varia consoante a região. O DQ2.5 é mais frequente entre pessoas do norte e oeste da Europa, em particular no País Basco e na Irlanda,[76] e em partes de África, estando ainda associada à doença na Índia,[77] mas não se encontra em grande parte da costa do Pacífico. O DQ8 está mais distribuído do que o DQ2.5 e é especialmente comum na América Central e do Sul. Cerca de 90% dos indivíduos de algumas populações ameríndias apresentam o DQ8, pelo que podem apresentar o fenótipo celíaco.[78]
Têm também sido sucessivamente reportados outros fatores genéticos na doença celíaca. No entanto, a aceitação do seu envolvimento na doença varia conforme a região. Só o loci HLA-DQ demonstra estar envolvido de forma consistente na população mundial.[79] Muitos dos loci detetados estão associados a outras doenças autoimunes. Um locus, o gene LPP (lipoma-preferred partner), está envolvido na aderência de matrizes extracelulares à superfície da célula. Uma variante menor (SNP = rs1464510) aumenta o risco da doença em cerca de 30%.[79]
Esta prevalência de genótipos de doença celíaca na população contemporânea ainda não é completamente compreendida. Dadas as características da doença e a sua aparente forte hereditariedade, seria de esperar que os genótipos sofressem seleção negativa e estivessem ausentes em sociedades onde a agricultura fosse praticada há mais tempo; compare-se, por exemplo, com a intolerância à lactose, uma condição semelhante que sofreu seleção negativa de tal forma que a sua prevalência diminuiu de aproximadamente 100% nas populações da antiguidade para menos de 5% em alguns países europeus.[80] No entanto, não aparenta ser o caso; pelo contrário, existem evidências de seleção positiva nos genótipos de doença celíaca. Suspeita-se que alguns deles possam ter sido benéficos ao proporcionar proteção contra infeções bacterianas.[81][82]
Prolaminas |
A maioria das proteínas alimentares responsável pela reação imunitária na doença celíaca são as prolaminas. As prolaminas são proteínas de armazenamento ricas em prolina que se dissolvem em álcoois e são resistente às proteases e peptidases do intestino.[28][83] As prolaminas encontram-se em cereais, tendo cada tipo de cereal prolaminas diferentes, mas relacionadas entre si: trigo (gliadina), cevada (hordeína), centeio (secalina), milho (zeína) e na aveia (avenina). Uma região da α-gliadina estimula as células membranares do intestino para permitir a passagem de moléculas de grande dimensão pelo selante entre as células. A interferência das uniões herméticas permite aos peptídeos maiores do que três aminoácidos entrar na circulação.[84]
A abertura da membrana permite que os peptídeos da gliadina estimulem dois níveis de resposta imunitária, a resposta imunitária inata e a resposta adquirida. Um peptídeo da α-gliadina resistente à protease contém uma região que estimula linfócitos, o que provoca a libertação de interleucina 15. Esta resposta inata à gliadina por sua vez provoca sinalização no sistema imunitário que atrai células inflamatórias e aumenta a libertação de químicos inflamatórios.[28] A resposta adquirida à gliadina mais forte e mais comum é dirigida a um fragmento α2-gliadina com 33 aminoácidos de comprimento.[28]
Esta resposta ocorre em maior parte dos celíacos que têm a isoforma DQ2. Este peptídeo, quando modificado pela transglutaminase intestinal, apresenta uma elevada densidade de epítopos de linfócitos T sobrepostos, o que aumenta a probabilidade de que a isoforma DQ2 se ligue e se mantenha ligada ao peptídeo quando reconhecida pelos linfócitos T.[85] A gliadina do trigo é o membro melhor compreendido desta família, embora existam outras prolaminas capazes de contribuir para a doença celíaca.[28][86]
Transglutaminase tecidular |

Transglutaminase tecidular, desenhada a partir de PDB 1FAU
Na maioria dos casos da doença, observa-se a presença de anticorpos anti-transglutaminase para a enzima transglutaminase tecidular (tTG).[87] A transglutaminase tecidular modifica os peptídeos de glúten numa forma capaz de estimular o sistema imunitário de forma mais eficaz.[28] Estes peptídeos são modificados pela tTG de duas formas: desaminação ou transaminação.[88]
A desaminação é a reação pela qual se forma um resíduo de glutamato através da clivagem do aminogrupo épsilon de uma cadeia de glutamina. A transaminação, que ocorre com uma frequência três vezes superior, corresponde à ligação cruzada de um resíduo de glutamina com um resíduo de lisina da tTG, numa reação que á catalisada pela transglutaminase. A ligação cruzada pode ocorrer tanto dentro como fora do sítio ativo da enzima. Neste último caso, é produzido um complexo ligado de forma covalente e permanente entre a gliadina e a tTG.[89] Isto leva à formação de novos epítopos, os quais se acredita desencadearem a resposta imunitária primária mediante a qual se desenvolvem os autoanticorpos contra a iTG.[90][91][92]
As biópsias de pessoas suspeitas da doença revelaram que os depósitos de autoanticorpos em celíacos sub-clínicos são detetados antes da doença entrar em fase clínica. Estes depósitos também se encontram em pessoas com outras doenças autoimunes, anemia ou fenómenos de má absorção, a taxas muito superiores à população normal.[93] Acredita-se que os componentes endomísios dos anticorpos (EMA) para a tTG sejam destinados à transglutaminase na superfície celular, pelo que estes anticorpos são ainda usados para confirmar um diagnóstico de doença celíaca. No entanto, um estudo de 2006 demonstrou que os celíacos sem EMA tendem a ser homens mais idosos com sintomas abdominais mais graves e menor frequência de sintomas atípicos, incluindo doença autoimune.[94] O mesmo estudo não encontrou relação entre os depósitos de anticorpos anti-tTG e a gravidade da destruição da vilosidades do intestino. Estas descobertas, a par de outras mais recentes que demonstram que a gliadina tem um componente de resposta inata,[95] sugerem que a gliadina possa ter maior responsabilidade nas manifestações primárias da doença celíaca, enquanto que a tTG é um maior fator nos efeitos secundários, como as respostas alérgicas e doenças autoimunes secundárias. Numa grande percentagem de pessoas com doença celíaca, os anticorpos anti-tTG também reconhecem uma proteína de um rotavírus denominada VP7. Estes anticorpos estimulam a proliferação de monócitos e a infeção por rotavírus pode explicar alguns dos estágios iniciais da proliferação de glóbulos brancos.[96] De facto, os primeiros estudos de lesões por rotavírus no intestino demonstram que estes provocam atrofia das vilosidades.[97]
Atrofia das vilosidades e má absorção |
O processo inflamatório, mediado pelos linfócitos T, leva à destruição da estrutura e função da mucosa que reveste o intestino delgado. Este processo causa má-absorção intestinal, uma vez que debilita a capacidade do corpo em absorver nutrientes, sais minerais e as vitaminas lipossolúveis A, D, E e K a partir dos alimentos. A diminuição da superfície do intestino e a diminuição da produção de lactase podem também causar intolerância à lactose, embora desapareça quando a condição é tratada.[34][40]
Têm vindo a ser propostas causas alternativas para estas lesões no tecido que envolvem a libertação de interleucina 15 e a ativação do sistema imune inato por um peptídeo de glúten mais curto (p31–43/49). Este processo desencadearia a morte dos enterócitos pelos linfócitos no epitélio.[28] A atrofia das vilosidades observada nas biópsias pode também ser devida a causas sem relação com a doença, como esprú tropical, giardiose ou exposição a radiação. Embora um resultado serológico positivo e a confirmação por biópsia sejam sugestivos de doença celíaca, na ausência de resposta à dieta pode ser necessário considerar estes diagnósticos alternativos.[39]
Rastreio |
Devido à sua elevada sensibilidade, a serologia tem vindo a ser proposta para medida de rastreio, uma vez que a presença de anticorpos detetaria casos não diagnosticados de doença celíaca e preveniria complicações nessas pessoas.[39] No entanto, existe um debate considerável sobre os benefícios do rastreio. Alguns estudos sugerem que a deteção precoce diminuiria o risco de osteoporose e anemia. Por outro lado, um estudo coorte sugeriu que a doença celíaca não diagnosticada apresentava alguns benefícios ao diminuir o risco de doenças cardiovasculares (menos sobrepeso, diminuição do colesterol).[28] Há poucas evidências de que os casos detetados por rastreio beneficiariam de um diagnóstico em termos de morbidade e mortalidade, pelo que atualmente não se acredita que o rastreio de toda a população possa ter benefícios.[34]
No Reino Unido recomenda-se o rastreio de doença celíaca em pessoas a quem foi recentemente diagnosticada síndrome da fadiga crónica,[98] e síndrome do intestino irritável,[36] assim como a diabéticos do tipo 1, em particular daqueles com pouco ganho de peso ou perda de peso inexplicável.[22][99] O rastreio também é recomendado no caso de tiroidite autoimune, dermatite herpetiforme e nos parentes em primeiro grau de pessoas com doença celíaca confirmada.[22]
Tratamento |
Dieta isenta de glúten |

Uma dieta isenta de glúten exclui todos os alimentos que contêm glúten, como o trigo, a cevada ou o centeio, bem como alimentos processados que contenham esses cereais ou que tenham sido manipulados nas mesmas instalações.[100]
Atualmente, o único tratamento eficaz é uma dieta isenta de glúten durante toda a vida.[49] Não existem medicamentos capazes de impedir as lesões ou impedir que o corpo ataque o intestino na presença de glúten. A adesão rigorosa à dieta permite que os intestinos se curem naturalmente, o que na maior parte dos casos leva ao desaparecimento dos sintomas e, se a dieta for iniciada suficientemente cedo, à eliminação do risco acrescido de osteoporose, cancro do cólon e, nalguns casos, da esterilidade.[101]
Geralmente é necessário o acompanhamento de um nutricionista para assegurar que a pessoa tem conhecimento dos alimentos que contêm glúten, daqueles que é seguro ingerir e como conseguir uma dieta equilibrada apesar das limitações. Os produtos sem glúten são geralmente mais caros e difíceis de encontrar do que os produtos normais. Em vários países, os produtos isentos de glúten podem ser receitados e o valor reembolsado através de seguros de saúde.[102] Uma vez que grande parte dos alimentos prontos a comer contêm vestígios de glúten, alguns celíacos consideram que é essencial cozinhar as próprias refeições.[103]
O termo "isento de glúten" encontrado nas embalagens é geralmente usado para indicar uma quantidade alegadamente inócua de glúten, e não a ausência completa.[104] No entanto, a quantidade exata em que o glúten é inócuo é controversa e incerta. Uma revisão sistemática recente concluiu que é improvável que o consumo de menos de 10 mg de glúten por dia possa causar anormalidades histológicas, embora também saliente que ainda tenham sido feitos poucos estudos fidedignos.[104] A regulamentação do rótulo "isento de glúten" varia. Na União Europeia, a Comissão publicou uma diretiva em 2009 que limita o uso do rótulo "isento de glúten" a produtos alimentares com menos de 20 mg/kg de glúten, e o uso do rótulo "teor muito baixo de glúten" a produtos com menos de 100 mg/kg.[105] Nos Estados Unidos, a Food and Drug Administration publicou regulamentação em 2013 que limitava o uso do rótulo "isento de glúten" a produtos com menos de 20 ppm de glúten.[106] O atual padrão internacional Codex Alimentarius permite quantidades até 20 ppm de glúten nos alimentos designados "isentos de glúten".[107]
Mesmo após a adesão a uma dieta rigorosa, a qualidade de vida dos celíacos pode ser menor. Diversos estudos nos Estados Unidos revelaram que a qualidade de vida se torna comparável à generalidade da população após algum tempo na dieta, enquanto que diversos estudos na Europa mostraram que a qualidade de vida se mantém inferior, embora os questionários não sejam idênticos.[108] Os homens tendem a reportar mais melhorias do que as mulheres.[109] Algumas pessoas apresentam sintomas digestivos persistentes ou dermatite herpetiforme, úlceras na boca, osteoporose e respetivas fraturas. Podem ainda manifestar-se sintomas sugestivos de síndrome do intestino irritável e verificar-se um aumento da prevalência de ansiedade, fadiga, dispepsia e dores musculares.[110]
Doença refratária |
Numa pequena minoria das pessoas verifica-se doença refratária, o que significa que não melhoram mesmo após uma dieta isenta de glúten. Isto pode dever-se ao facto da doença estar há tanto tempo presente que os intestinos já não são capazes de se regenerar naturalmente, ou pela pessoa não estar a seguir a dieta de forma adequada ou porque a pessoa está a consumir inadvertidamente alimentos contaminados com glúten. Após exclusão de outras causas, nesta situação pode ser considerado o uso de esteroides ou imunossupressores.[39]
Epidemiologia |
A doença celíaca afeta em todo o mundo entre 1 em cada 100 e 1 em cada 170 pessoas. No entanto, entre as várias regiões a prevalência varia entre 1 em cada 300 e 1 em cada 40 pessoas.[14] Em vários estudos, a percentagem de pessoas com diagnóstico clínico da doença varia entre 0,05 e 0,27. No entanto, os estudos populacionais de partes da Europa, América do Sul, Australásia e Estados Unidos indicam que a percentagem de pessoas com a doença possa ser entre 0,33-1,06% em crianças e entre 0,18-1,2% em adultos.[28] Entre as pessoas que se apresentam nos cuidados de saúde primários com queixas gastrointestinais, a taxa de diagnósticos de doença celíaca é de cerca de 3%.[59] No passado, pensava-se que a doença celíaca era rara, com prevalência de apenas 0,02%.[111] É possível que o recente aumento no número de casos registados se deva aos avanços nas práticas de diagnóstico.[112] Nos Estados Unidos e na Europa, a prevalência da doença é de 0,75% em grupos fora de risco, o que aumenta para 1,8% em pessoas com sintomas, 2,6% em parentes em segundo grau (avós, tios, etc.) de pessoas com a doença e 4,5% em parentes em primeiro grau (filhos, pais).[38]
As pessoas de ascendência africana, japonesa e chinesa raramente são diagnosticadas,[113] o que é um reflexo da muito menor prevalência de fatores de risco genéticos nestas populações.[114] As pessoas de ascendência indiana e caucasiana apresentam risco idêntico.[38] Os estudos populacionais também indicam que grande parte dos celíacos não chega a ser diagnosticada. Isto deve-se, em parte, ao facto de muitos profissionais de saúde não estarem familiarizados com a condição e ao facto da doença poder ser assintomática.[115] A doença é ligeiramente mais prevalente em mulheres do que em homens.[116] Entre as populações com risco acrescido de ocorrência da doença, em que a taxa de prevalência varia entre 5 e 10%, estão as pessoas com síndrome de Down e de Turner, diabetes tipo 1 e doenças autoimunes da tiroide, incluindo hipertiroidismo e hipotiroidismo.[111]
Sociedade e cultura |
Igreja cristã e eucaristia |

O pão usado na missa deve obrigatoriamente ser feito de trigo, o que constitui um problema para católicos celíacos. Algumas igrejas têm à disposição hóstias com teor muito baixo de glúten.
Diversas denominações cristãs celebram a Eucaristia, na qual é abençoada e ingerida uma hóstia ou um pedaço de pão feitos a partir de trigo. A farinha de trigo contém entre 10 e 13% de glúten, pelo que cada hóstia pode conter mais de 50 mg de glúten, quantidade que é prejudicial à saúde de várias pessoas com doença celíaca, em particular se for consumida diariamente. Muitas igrejas oferecem alternativas sem glúten, geralmente uma bolacha à base de arroz ou pão sem glúten. No entanto, algumas igrejas oferecem apenas hóstias com teor reduzido de glúten, já que as que são completamente isentas de glúten não são consideradas pão de trigo, sendo portanto inapropriadas.[117]
Posição da igreja católica romana |
A doutrina católica romana afirma que para uma Eucaristia ser válida, o pão usado na missa deve obrigatoriamente ser feito a partir de trigo. Em 2002, a Congregação para a Doutrina da Fé aprovou hóstias com baixo teor de glúten para serem usadas em Itália. Embora não fossem inteiramente isentas de glúten, foram também aprovadas pela Associação de Celíacos Italiana.[118] Alguns celíacos católicos têm vindo a pedir permissão para o uso de hóstias feitas a partir de arroz. No entanto, estas petições têm sido sempre recusadas.[119] Em janeiro de 2004 passaram a estar disponíveis hóstias com um teor extremamente reduzido de glúten nos Estados Unidos, Itália e Austrália.[120]
Para os padres a questão é mais complexa. Enquanto celebrantes, exige-se que recebam o corpo de Cristo nas duas espécies. Em 2003, a Congregação para a Doutrina da Fé afirmou que "dada a centralidade da celebração da Eucaristia na vida de um padre, deve-se ponderar cuidadosamente antes de admitir à Santa Ordem candidatos que não sejam capazes de ingerir glúten ou álcool sem colocar em risco a sua saúde."[121]
Pessach |
O festival judaico do Pessach pode ser problemático para celíacos devido à obrigação de consumir matzá, pão ázimo feito de forma estritamente controlada a partir de trigo, cevada, espelta, aveia ou centeio. Isto exclui diversos outros cereais normalmente usados como substitutos por pessoas com sensibilidade ao glúten, particularmente para os Asquenazes, que também evitam o arroz. Muitos produtos kosher para o Pessach são isentos de cereais, não contendo glúten de todo. A fécula de batata é o principal produto utilizado como substituto. No entanto, consumir matzá só é obrigatório na primeira noite do Pessach e a lei judaica sustenta que ninguém deve colocar a sua saúde em risco apenas para cumprir um mandamento. Assim, a uma pessoa com doença celíaca grave não é permitido, muito menos exigido, que consuma outro matzá que não o isento de glúten, o qual é geralmente feito a partir de cevada.[122]
Investigação |
Estão a ser investigadas outras abordagens com o intuito de diminuir a necessidade de dieta, embora ainda estejam em fase de desenvolvimento e só é expectável que estejam disponíveis para a população em geral a longo prazo.[28] A utilização de espécies de trigo geneticamente modificadas, ou espécies obtidas a partir de cultura seletiva, podem vir a permitir o consumo de trigo. No entanto, é possível que isto interfira com o efeito benéfico da gliadina na qualidade da farinha. Em alternativa, a exposição ao glúten pode ser minimizada pela ingestão de uma combinação de enzimas (propil endopeptidase e cisteíno protease) que degradam o peptídeo 33-mer no duodeno.[28]
Entre os tratamentos alternativos que se encontram a ser investigados estão a inibição da zonulina, uma proteína sinalizadora endógena associada ao aumento da permeabilidade da parede intestinal, o que aumenta a apresentação da gliadina ao sistema imunitário. Estão também a ser investigados outros modificadores das fases melhor compreendidas da patogénese da doença celíaca, como a ação do HLA-DQ2 ou da transglutaminase tecidular e a interação MICA/NKG2D que pode estar envolvida na morte dos enterócitos.[28]
História |

Samuel Gee publicou em 1877 a primeira descrição moderna da doença, propondo que o tratamento só podia ser realizado por restrição do nutriente na dieta.
A humanidade iniciou o cultivo de cereais durante o neolítico (início c. 9500 a.C.) no Crescente Fértil na Ásia ocidental, sendo improvável que a doença celíaca tivesse existido antes desta época. Areteu da Capadócia, que viveu na mesma região durante o século II, salientou a existência de uma síndrome de má absorção, com diarreia crónica e que provocava uma debilitação do corpo inteiro.[32] Esta afeção "celíaca" (do grego κοιλιακός koiliakos, "abdominal") despertou o interesse da medicina ocidental quando foi apresentada uma tradução da obra de Areteu à Sydenham Society em 1856. O paciente descrito por Areteu apresentava dores de estômago e encontrava-se atrofiado, pálido, fraco e incapaz de trabalhar. A diarreia manifestava-se através de fezes líquidas esbranquiçadas, com mau cheio e flatulência, sendo a doença intratável e de aparecimento recorrente. Areteu acreditava que a diarreia tinha origem na falta de calor no estômago, o qual seria necessário para digerir a comida, e numa diminuição da capacidade em distribuir os produtos da digestão pelo corpo. Registou ainda que esta doença afetava os idosos e principalmente as mulheres, excluindo explicitamente as crianças. A causa, de acordo com Areteu, podia ser outra doença crónica ou até mesmo a ingestão de quantidades copiosas de água fria.[32][33]
O pediatra Samuel Gee fez a primeira descrição moderna da doença em crianças durante uma palestra no hospital pediátrico de Great Ormond Street em Londres em 1877. Gee conhecia as anteriores descrições e termos para a doença, tendo adotado o mesmo termo que Areteu (doença celíaca). Afirmou também que se o paciente puder ser curado, deverá ser através da dieta. Reconheceu ainda que a intolerância ao leite é um problema característico de crianças celíacas e que devem ser evitados alimentos ricos em amido. No entanto, também proibia o consumo de arroz, fruta e vegetais, os quais são seguros para consumo, e recomendava a ingestão de carne crua e fatias finas de pão torrado. Gee salientava o sucesso em particular de uma criança alimentada diariamente com mexilhões, embora a mesma criança não tivesse sido capaz de sustentar essa mesma dieta por mais do que uma estação.[33][123]
Christian Archibald Herter, um médico norte-americano, escreveu em 1908 um livro sobre crianças com a doença celíaca, a qual designava por "infantilismo intestinal". Herter verificou atrasos no crescimento e que a gordura era melhor tolerada que os hidratos de carbono. O epónimo "doença de Gee-Herter" era por vezes utilizado em reconhecimento das suas contribuições.[124] Sidney Haas, um pediatra norte-americano, descreveu em 1924 os benefícios de uma dieta à base de bananas em celíacos.[125] Esta dieta continuou a ser popular até ser determinada a verdadeira causa da doença celíaca.[33]
Embora se suspeitasse do papel dos hidratos de carbono, a associação da doença com o trigo só seria feita na década de 1940 pelo pediatra holandês Willem Karel Dicke.[126] É provável que para esta descoberta tenha contribuído a melhoria dos seus pacientes durante a grande fome holandesa de 1944, durante a qual a farinha era escassa.[127] Dicke reparou que a escassez de pão levou a que a taxa de mortalidade entre crianças celíacas tivesse diminuído drasticamente, desde mais de 35% até praticamente zero. Reportou também que a partir do momento em que o trigo voltou a estar disponível após a guerra, a taxa de mortalidade regressou aos números anteriores.[128] A ligação com o glúten do trigo foi feita em 1952 por uma equipa de Birmingham, em Inglaterra.[129] A atrofia das vilosidades do intestino foi descrita pelo médico britânico John W. Paulley em 1954, a partir de amostras recolhidas durante cirurgias,[130] o que abriu caminho à recolha de amostras por endoscopia.[33] Ao longo da década de 1960 foram descobertas novas características da doença. O seu caráter hereditário foi reconhecido em 1965.[131] Em 1966, a dermatite herpetiforme foi associada à sensibilidade ao glúten.[33][44]
Notas
↑ abcde Fasano A (abril de 2005). «Clinical presentation of celiac disease in the pediatric population». Gastroenterology (Review). 128 (4 Suppl 1): S68-73. PMID 15825129. doi:10.1053/j.gastro.2005.02.015
↑ «Symptoms & Causes of Celiac Disease | NIDDK». National Institute of Diabetes and Digestive and Kidney Diseases. Junho de 2016. Consultado em 24 de abril de 2017. Cópia arquivada em 24 de abril de 2017
↑ ab Lebwohl B, Ludvigsson JF, Green PH (outubro de 2015). «Celiac disease and non-celiac gluten sensitivity». BMJ (Review). 351: h4347. PMC 4596973 . PMID 26438584. doi:10.1136/bmj.h4347.
. PMID 26438584. doi:10.1136/bmj.h4347. Celiac disease occurs in about 1% of the population worldwide, although most people with the condition are undiagnosed. It can cause a wide variety of symptoms, both intestinal and extra-intestinal because it is a systemic autoimmune disease that is triggered by dietary gluten. Patients with celiac disease are at increased risk of cancer, including a twofold to fourfold increased risk of non-Hodgkin’s lymphoma and a more than 30-fold increased risk of small intestinal adenocarcinoma, and they have a 1.4-fold increased risk of death.
↑ ab Lundin KE, Wijmenga C (Setembro de 2015). «Coeliac disease and autoimmune disease-genetic overlap and screening». Nat Rev Gastroenterol Hepatol (Review). 12 (9): 507–15. PMID 26303674. doi:10.1038/nrgastro.2015.136.The abnormal immunological response elicited by gluten-derived proteins can lead to the production of several different autoantibodies, which affect different systems.
↑ ab «Celiac disease». World Gastroenterology Organisation Global Guidelines. Julho de 2016. Consultado em 23 de abril de 2017. Cópia arquivada em 17 de março de 2017
↑ abcd Ciccocioppo R, Kruzliak P, Cangemi GC, Pohanka M, Betti E, Lauret E, Rodrigo L (22 de outubro de 2015). «The Spectrum of Differences between Childhood and Adulthood Celiac Disease». Nutrients (Review). 7 (10): 8733–51. PMC 4632446 . PMID 26506381. doi:10.3390/nu7105426.
. PMID 26506381. doi:10.3390/nu7105426. Several additional studies in extensive series of celiac patients have clearly shown that TG2A sensitivity varies depending on the severity of duodenal damage, and reaches almost 100% in the presence of complete villous atrophy (more common in children under three years), 70% for subtotal atrophy, and up to 30% when only an increase in IELs is present. (IELs: intraepithelial lymphocytes)
↑ Lionetti E, Francavilla R, Pavone P, Pavone L, Francavilla T, Pulvirenti A, et al. (2010). «The neurology of coeliac disease in childhood: what is the evidence? A systematic review and meta-analysis». Dev Med Child Neurol. 52 (8): 700–7. PMID 20345955. doi:10.1111/j.1469-8749.2010.03647.x. Cópia arquivada em 25 de abril de 2016
↑ abcd Husby S, Koletzko S, Korponay-Szabó IR, Mearin ML, Phillips A, Shamir R, Troncone R, Giersiepen K, Branski D, Catassi C, Lelgeman M, Mäki M, Ribes-Koninckx C, Ventura A, Zimmer KP, ESPGHAN Working Group on Coeliac Disease Diagnosis; ESPGHAN Gastroenterology Committee; European Society for Pediatric Gastroenterology, Hepatology, and Nutrition (Janeiro de 2012). «European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease» (PDF). J Pediatr Gastroenterol Nutr (Practice Guideline). 54 (1): 136–60. PMID 22197856. doi:10.1097/MPG.0b013e31821a23d0. Cópia arquivada (PDF) em 3 de abril de 2016.Since 1990, the understanding of the pathological processes of CD has increased enormously, leading to a change in the clinical paradigm of CD from a chronic, gluten-dependent enteropathy of childhood to a systemic disease with chronic immune features affecting different organ systems. (...) atypical symptoms may be considerably more common than classic symptoms
↑ ab Tovoli F, Masi C, Guidetti E, Negrini G, Paterini P, Bolondi L (16 de março de 2015). «Clinical and diagnostic aspects of gluten related disorders». World J Clin Cases (Review). 3 (3): 275–84. PMC 4360499 . PMID 25789300. doi:10.12998/wjcc.v3.i3.275
. PMID 25789300. doi:10.12998/wjcc.v3.i3.275
↑ abcdefg «Celiac Disease». NIDDKD. Junho de 2015. Consultado em 17 de março de 2016. Cópia arquivada em 13 de março de 2016
↑ ab Vivas S, Vaquero L, Rodríguez-Martín L, Caminero A (6 de novembro de 2015). «Age-related differences in celiac disease: Specific characteristics of adult presentation». World J Gastrointest Pharmacol Ther (Review). 6 (4): 207–12. PMC 4635160 . PMID 26558154. doi:10.4292/wjgpt.v6.i4.207.
. PMID 26558154. doi:10.4292/wjgpt.v6.i4.207. In addition, the presence of intraepithelial lymphocytosis and/or villous atrophy and crypt hyperplasia of small-bowel mucosa, and clinical remission after withdrawal of gluten from the diet, are also used for diagnosis antitransglutaminase antibody (tTGA) titers and the degree of histological lesions inversely correlate with age. Thus, as the age of diagnosis increases antibody titers decrease and histological damage is less marked. It is common to find adults without villous atrophy showing only an inflammatory pattern in duodenal mucosa biopsies: Lymphocytic enteritis (Marsh I) or added crypt hyperplasia (Marsh II)
↑ Ferri, Fred F. (2010). Ferri's differential diagnosis : a practical guide to the differential diagnosis of symptoms, signs, and clinical disorders 2ª ed. Philadelphia, PA: Elsevier/Mosby. p. Chapter C. ISBN 0323076998
↑ ab See JA, Kaukinen K, Makharia GK, Gibson PR, Murray JA (Outubro de 2015). «Practical insights into gluten-free diets». Nat Rev Gastroenterol Hepatol (Review). 12 (10): 580–91. PMID 26392070. doi:10.1038/nrgastro.2015.156.A lack of symptoms and/or negative serological markers are not reliable indicators of mucosal response to the diet. Furthermore, up to 30% of patients continue to have gastrointestinal symptoms despite a strict GFD.122,124 If adherence is questioned, a structured interview by a qualified dietitian can help to identify both intentional and inadvertent sources of gluten.
↑ abc Fasano, A; Catassi, C (20 de dezembro de 2012). «Clinical practice. Celiac disease». The New England Journal of Medicine (Review). 367 (25): 2419–26. PMID 23252527. doi:10.1056/NEJMcp1113994
↑ Newnham ED (2017). «Coeliac disease in the 21st century: paradigm shifts in the modern age». J Gastroenterol Hepatol (Review). 32 Suppl 1: 82–85. PMID 28244672. doi:10.1111/jgh.13704. Cópia arquivada em 16 de março de 2017.Presentation of CD with malabsorptive symptoms or malnutrition is now the exception rather than the rule
Predefinição:Free access
↑ ab Rostami Nejad M, Hogg-Kollars S, Ishaq S, Rostami K (2011). «Subclinical celiac disease and gluten sensitivity». Gastroenterol Hepatol Bed Bench (Review). 4 (3): 102–8. PMC 4017418 . PMID 24834166
. PMID 24834166
↑ Tonutti E, Bizzaro N (2014). «Diagnosis and classification of celiac disease and gluten sensitivity». Autoimmun Rev (Review). 13 (4–5): 472–6. PMID 24440147. doi:10.1016/j.autrev.2014.01.043
↑ abc Penagini F, Dilillo D, Meneghin F, Mameli C, Fabiano V, Zuccotti GV (18 de novembro de 2013). «Gluten-free diet in children: an approach to a nutritionally adequate and balanced diet». Nutrients (Review). 5 (11): 4553–65. PMC 3847748 . PMID 24253052. doi:10.3390/nu5114553
. PMID 24253052. doi:10.3390/nu5114553
↑ ab Di Sabatino A, Corazza GR (Abril de 2009). «Coeliac disease». Lancet. 373 (9673): 1480–93. PMID 19394538. doi:10.1016/S0140-6736(09)60254-3
↑ Comino I, Moreno Mde L, Sousa C (7 de novembro de 2015). «Role of oats in celiac disease». World J Gastroenterol. 21 (41): 11825–31. PMC 4631980 . PMID 26557006. doi:10.3748/wjg.v21.i41.11825.
. PMID 26557006. doi:10.3748/wjg.v21.i41.11825. It is necessary to consider that oats include many varieties, containing various amino acid sequences and showing different immunoreactivities associated with toxic prolamins. As a result, several studies have shown that the immunogenicity of oats varies depending on the cultivar consumed. Thus, it is essential to thoroughly study the variety of oats used in a food ingredient before including it in a gluten-free diet.
↑ Pinto-Sánchez, María Inés; Causada-Calo, Natalia; Bercik, Premysl; Ford, Alexander C.; Murray, Joseph A.; Armstrong, David; Semrad, Carol; Kupfer, Sonia S.; Alaedini, Armin; Moayyedi, Paul; Leffler, Daniel A.; Verdú, Elena F.; Green, Peter (Abril de 2017). «Safety of Adding Oats to a Gluten-free Diet for Patients with Celiac Disease: Systematic Review and Meta-analysis of Clinical and Observational Studies». Gastroenterology. 153: 395–409.e3. doi:10.1053/j.gastro.2017.04.009
↑ abcdefghi National Institute for Health and Clinical Excellence. Clinical guideline 86: Recognition and assessment of coeliac disease. Londres, 2009.
↑ Matthias T, Pfeiffer S, Selmi C, Eric Gershwin M (abril de 2010). «Diagnostic challenges in celiac disease and the role of the tissue transglutaminase-neo-epitope». Clin Rev Allergy Immunol (Review). 38 (2–3): 298–301. PMID 19629760. doi:10.1007/s12016-009-8160-z
↑ Lewis NR, Scott BB (1 de julho de 2006). «Systematic review: the use of serology to exclude or diagnose coeliac disease (a comparison of the endomysial and tissue transglutaminase antibody tests)». Aliment Pharmacol Ther (Review). 24 (1): 47–54. PMID 16803602. doi:10.1111/j.1365-2036.2006.02967.x. Cópia arquivada em 4 de maio de 2016
↑ Rostom A, Murray JA, Kagnoff MF (dezembro de 2006). «American Gastroenterological Association (AGA) Institute technical review on the diagnosis and management of celiac disease». Gastroenterology (Review). 131 (6): 1981–2002. PMID 17087937. doi:10.1053/j.gastro.2006.10.004
↑ Molina-Infante J, Santolaria S, Sanders DS, Fernández-Bañares F (Maio de 2015). «Systematic review: noncoeliac gluten sensitivity». Aliment Pharmacol Ther (Review). 41 (9): 807–20. PMID 25753138. doi:10.1111/apt.13155.Furthermore, seronegativity is more common in coeliac disease patients without villous atrophy (Marsh 1-2 lesions), but these ‘minor’ forms of coeliac disease may have similar clinical manifestations to those with villous atrophy and may show similar clinical–histological remission with reversal of haematological or biochemical disturbances on a gluten-free diet (GFD).
↑ Ludvigsson JF, Card T, Ciclitira PJ, Swift GL, Nasr I, Sanders DS, Ciacci C (abril de 2015). «Support for patients with celiac disease: A literature review». United European Gastroenterol J (Review). 3 (2): 146–59. PMC 4406900 . PMID 25922674. doi:10.1177/2050640614562599
. PMID 25922674. doi:10.1177/2050640614562599
↑ abcdefghijklmnop van Heel DA, West J (2006). «Recent advances in coeliac disease». Gut (Review). 55 (7): 1037–46. PMC 1856316 . PMID 16766754. doi:10.1136/gut.2005.075119
. PMID 16766754. doi:10.1136/gut.2005.075119
↑ US Preventive Services Task, Force.; Bibbins-Domingo, K; Grossman, DC; Curry, SJ; Barry, MJ; Davidson, KW; Doubeni, CA; Ebell, M; Epling JW, Jr; Herzstein, J; Kemper, AR; Krist, AH; Kurth, AE; Landefeld, CS; Mangione, CM; Phipps, MG; Silverstein, M; Simon, MA; Tseng, CW (28 de março de 2017). «Screening for Celiac Disease: US Preventive Services Task Force Recommendation Statement.». JAMA. 317 (12): 1252–1257. PMID 28350936. doi:10.1001/jama.2017.1462
↑ Lionetti E, Gatti S, Pulvirenti A, Catassi C (junho de 2015). «Celiac disease from a global perspective». Best Pract Res Clin Gastroenterol (Review). 29 (3): 365–79. PMID 26060103. doi:10.1016/j.bpg.2015.05.004
↑ Hischenhuber C, Crevel R, Jarry B, Mäki M, Moneret-Vautrin DA, Romano A, Troncone R, Ward R (Março de 2006). «Review article: safe amounts of gluten for patients with wheat allergy or coeliac disease». Aliment. Pharmacol. Ther. 23 (5): 559–75. PMID 16480395. doi:10.1111/j.1365-2036.2006.02768.x
↑ abc Adams F, translator (1856). «On The Cœliac Affection». The extant works of Aretaeus, The Cappadocian. London: Sydenham Society. pp. 350–1. Consultado em 12 de dezembro de 2009
↑ abcdef Losowsky MS (2008). «A history of coeliac disease». Dig Dis. 26 (2): 112–20. PMID 18431060. doi:10.1159/000116768
↑ abcdefghijk Di Sabatino A, Corazza GR (Abril de 2009). «Coeliac disease». Lancet. 373 (9673): 1480–93. PMID 19394538. doi:10.1016/S0140-6736(09)60254-3
↑ Ferguson R, Basu MK, Asquith P, Cooke WT (1976). «Jejunal mucosal abnormalities in patients with recurrent aphthous ulceration». Br Med J. 1 (6000): 11–13. PMC 1638254 . PMID 1247715. doi:10.1136/bmj.1.6000.11 !CS1 manut: Nomes múltiplos: lista de autores (link)
. PMID 1247715. doi:10.1136/bmj.1.6000.11 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ ab National Institute for Health and Clinical Excellence. Clinical guideline 61: Irritable bowel syndrome. Londres, 2008.
↑ Freeman HJ (Dezembro de 2009). «Adult Celiac Disease and Its Malignant Complications». Gut and Liver. 3 (4): 237–46. PMC 2852736 . PMID 20431755. doi:10.5009/gnl.2009.3.4.237
. PMID 20431755. doi:10.5009/gnl.2009.3.4.237
↑ abc Gujral N, Freeman HJ, Thomson AB (Novembro de 2012). «Celiac disease: prevalence, diagnosis, pathogenesis and treatment.» (PDF). World Journal of Gastroenterology. 18 (42): 6036–59. PMC 3496881 . PMID 23155333. doi:10.3748/wjg.v18.i42.6036 !CS1 manut: Nomes múltiplos: lista de autores (link)
. PMID 23155333. doi:10.3748/wjg.v18.i42.6036 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ abcdefghi «American Gastroenterological Association medical position statement: Celiac Sprue». Gastroenterology. 120 (6): 1522–5. 2001. PMID 11313323. doi:10.1053/gast.2001.24055
↑ abcd Presutti RJ, Cangemi JR, Cassidy HD, Hill DA (2007). «Celiac disease». Am Fam Physician. 76 (12): 1795–802. PMID 18217518 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ ab Pietzak MM (2014). «Dietary supplements in celiac disease». In: Rampertab SD, Mullin GE. Celiac disease. [S.l.: s.n.] pp. 137–59. ISBN 978-1-4614-8559-9
↑ Tursi A, Brandimarte G, Giorgetti G (2003). «High prevalence of small intestinal bacterial overgrowth in celiac patients with persistence of gastrointestinal symptoms after gluten withdrawal». Am J Gastroenterol. 98 (4): 839–43. PMID 12738465. doi:10.1111/j.1572-0241.2003.07379.x !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Cunningham-Rundles C (Setembro de 2001). «Physiology of IgA and IgA deficiency». J. Clin. Immunol. 21 (5): 303–9. PMID 11720003. doi:10.1023/A:1012241117984
↑ ab Marks J, Shuster S, Watson AJ (1966). «Small-bowel changes in dermatitis herpetiformis». Lancet. 2 (7476): 1280–2. PMID 4163419. doi:10.1016/S0140-6736(66)91692-8 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Nicolas ME, Krause PK, Gibson LE, Murray JA (Agosto de 2003). «Dermatitis herpetiformis». Int. J. Dermatol. 42 (8): 588–600. PMID 12890100. doi:10.1046/j.1365-4362.2003.01804.x !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Tersigni, C.; Castellani, R.; de Waure, C.; Fattorossi, A.; De Spirito, M.; Gasbarrini, A.; Scambia, G.; Di Simone, N. (2014). «Celiac disease and reproductive disorders: meta-analysis of epidemiologic associations and potential pathogenic mechanisms». Human Reproduction Update. 20 (4): 582–593. ISSN 1355-4786. doi:10.1093/humupd/dmu007 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Ferguson A, Hutton MM, Maxwell JD, Murray D (1970). «Adult coeliac disease in hyposplenic patients». Lancet. 1 (7639): 163–4. PMID 4189238. doi:10.1016/S0140-6736(70)90405-8 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Schuppan D, Junker Y, Barisani D (Dezembro de 2009). «Celiac disease: from pathogenesis to novel therapies». Gastroenterology. 137 (6): 1912–33. PMID 19766641. doi:10.1053/j.gastro.2009.09.008 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ abcde Kupper C (2005). «Dietary guidelines and implementation for celiac disease». Gastroenterology. 128 (4 Supl. 1): S121–7. PMID 15825119. doi:10.1053/j.gastro.2005.02.024
↑ Gallagher, Eimear (2009). Gluten-free Food Science and Technology. [S.l.]: John Wiley and Sons. p. 320. ISBN 978-1-4051-5915-9
↑ Stene LC, Honeyman MC, Hoffenberg EJ, Haas JE, Sokol RJ, Emery L, Taki I, Norris JM, Erlich HA, Eisenbarth GS, Rewers M (2006). «Rotavirus infection frequency and risk of celiac disease autoimmunity in early childhood: a longitudinal study». Am J Gastroenterol. 101 (10): 2333–40. PMID 17032199. doi:10.1111/j.1572-0241.2006.00741.x !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Kagnoff MF, Paterson YJ, Kumar PJ, Kasarda DD, Carbone FR, Unsworth DJ, Austin RK (1987). «Evidence for the role of a human intestinal adenovirus in the pathogenesis of coeliac disease». Gut. 28 (8): 995–1001. PMC 1433141 . PMID 2822550. doi:10.1136/gut.28.8.995 !CS1 manut: Nomes múltiplos: lista de autores (link)
. PMID 2822550. doi:10.1136/gut.28.8.995 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Suman S, Williams EJ, Thomas PW, Surgenor SL, Snook JA (2003). «Is the risk of adult coeliac disease causally related to cigarette exposure?». Eur J Gastroenterol Hepatol. 15 (9): 995–1000. PMID 12923372. doi:10.1097/00042737-200309000-00009 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Norris JM, Barriga K, Hoffenberg EJ, Taki I, Miao D, Haas JE, Emery LM, Sokol RJ, Erlich HA, Eisenbarth GS, Rewers M (2005). «Risk of celiac disease autoimmunity and timing of gluten introduction in the diet of infants at increased risk of disease». JAMA. 293 (19): 2343–2351. PMID 15900004. doi:10.1001/jama.293.19.2343 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Poole JA, Barriga K, Leung DY, Hoffman M, Eisenbarth GS, Rewers M, Norris JM (2006). «Timing of initial exposure to cereal grains and the risk of wheat allergy». Pediatrics. 117 (6): 2175–82. PMID 16740862. doi:10.1542/peds.2005-1803 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Akobeng AK, Ramanan AV, Buchan I, Heller RF (2006). «Effect of breast feeding on risk of coeliac disease: a systematic review and meta-analysis of observational studies». Arch Dis Child. 91 (1): 39–43. PMC 2083075 . PMID 16287899. doi:10.1136/adc.2005.082016 !CS1 manut: Nomes múltiplos: lista de autores (link)
. PMID 16287899. doi:10.1136/adc.2005.082016 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Health Canada. «The Gluten Connection». Consultado em 1 de outubro de 2013
↑ Hopper AD, Cross SS, Hurlstone DP, McAlindon ME, Lobo AJ, Hadjivassiliou M, Sloan ME, Dixon S, Sanders DS (2007). «Pre-endoscopy serological testing for coeliac disease: evaluation of a clinical decision tool». BMJ. 334 (7596). 729 páginas. PMC 1847864 . PMID 17383983. doi:10.1136/bmj.39133.668681.BE !CS1 manut: Nomes múltiplos: lista de autores (link)
. PMID 17383983. doi:10.1136/bmj.39133.668681.BE !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ abc van der Windt DA, Jellema P, Mulder CJ, Kneepkens CM, van der Horst HE (2010). «Diagnostic testing for celiac disease among patients with abdominal symptoms: a systematic review». JAMA. 303 (17): 1738–46. PMID 20442390. doi:10.1001/jama.2010.549 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Sblattero D, Berti I, Trevisiol C, Marzari R, Tommasini A, Bradbury A, Fasano A, Ventura A, Not T (2000). «Human recombinant tissue transglutaminase ELISA: an innovative diagnostic assay for celiac disease». Am. J. Gastroenterol. 95 (5): 1253–7. PMID 10811336. doi:10.1111/j.1572-0241.2000.02018.x !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ ab Hill ID, Dirks MH, Liptak GS, Colletti RB, Fasano A, Guandalini S, Hoffenberg EJ, Horvath K, Murray JA, Pivor M, Seidman EG (2005). «Guideline for the diagnosis and treatment of celiac disease in children: recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition». J. Pediatr. Gastroenterol. Nutr. 40 (1): 1–19. PMID 15625418. doi:10.1097/00005176-200501000-00001 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Korponay-Szabó IR, Dahlbom I, Laurila K, Koskinen S, Woolley N, Partanen J, Kovács JB, Mäki M, Hansson T (2003). «Elevation of IgG antibodies against tissue transglutaminase as a diagnostic tool for coeliac disease in selective IgA deficiency». Gut. 52 (11): 1567–71. PMC 1773847 . PMID 14570724. doi:10.1136/gut.52.11.1567 !CS1 manut: Nomes múltiplos: lista de autores (link)
. PMID 14570724. doi:10.1136/gut.52.11.1567 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ ab Hill ID (Abril de 2005). «What are the sensitivity and specificity of serologic tests for celiac disease? Do sensitivity and specificity vary in different populations?» (PDF). Gastroenterology. 128 (4 Suppl 1): S25–32. PMID 15825123. doi:10.1053/j.gastro.2005.02.012
↑ Nandiwada SL, Tebo AE (Abril de 2013). «Testing for antireticulin antibodies in patients with celiac disease is obsolete: a review of recommendations for serologic screening and the literature». Clinical and vaccine immunology : CVI. 20 (4): 447–51. PMC 3623418 . PMID 23365209. doi:10.1128/CVI.00568-12
. PMID 23365209. doi:10.1128/CVI.00568-12
↑ Wong RC, Steele RH, Reeves GE, Wilson RJ, Pink A, Adelstein S (2003). «Antibody and genetic testing in coeliac disease». Pathology. 35 (4): 285–304. PMID 12959764. doi:10.1080/00313020307527 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ abc Hadithi M, von Blomberg BM, Crusius JB, Bloemena E, Kostense PJ, Meijer JW, Mulder CJ, Stehouwer CD, Peña AS (2007). «Accuracy of serologic tests and HLA-DQ typing for diagnosing celiac disease». Ann. Intern. Med. 147 (5): 294–302. PMID 17785484. doi:10.7326/0003-4819-147-5-200709040-00003 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Niveloni S, Fiorini A, Dezi R, Pedreira S, Smecuol E, Vazquez H, Cabanne A, Boerr LA, Valero J, Kogan Z, Mauriño E, Bai JC (1998). «Usefulness of videoduodenoscopy and vital dye staining as indicators of mucosal atrophy of celiac disease: assessment of interobserver agreement». Gastrointestinal Endoscopy. 47 (3): 223–229. PMID 9580349. doi:10.1016/S0016-5107(98)70317-7 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Mee AS, Burke M, Vallon AG, Newman J, Cotton PB (1985). «Small bowel biopsy for malabsorption: comparison of the diagnostic adequacy of endoscopic forceps and capsule biopsy specimens». Br Med J (Clin Res Ed). 291 (6498): 769–72. PMC 1417146 . PMID 3929934. doi:10.1136/bmj.291.6498.769 !CS1 manut: Nomes múltiplos: lista de autores (link)
. PMID 3929934. doi:10.1136/bmj.291.6498.769 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Marsh MN (1992). «Gluten, major histocompatibility complex, and the small intestine. A molecular and immunobiologic approach to the spectrum of gluten sensitivity ('celiac sprue')». Gastroenterology. 102 (1): 330–54. PMID 1727768
↑ Teixeira, Nelson FG (2012). Universidade da Beira Interior, ed. Doença Celíaca Atualizada (PDF). [S.l.: s.n.]
↑ Corazza GR, Villanacci V (1 de junho de 2005). «Coeliac disease». Journal of Clinical Pathology. 58 (6): 573–74. PMC 1770677 . PMID 15917404. doi:10.1136/jcp.2004.023978
. PMID 15917404. doi:10.1136/jcp.2004.023978
↑ Oberhuber G, Granditsch G, Vogelsang H (Outubro de 1999). «The histopathology of coeliac disease: time for a standardized report scheme for pathologists». Eur J Gastroenterol Hepatol. 11 (10): 1185–94. PMID 10524652. doi:10.1097/00042737-199910000-00019 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Corazza GR, Villanacci V, Zambelli C, Milione M, Luinetti O, Vindigni C, Chioda C, Albarello L, Bartolini D, Donato F (2007). «Comparison of the interobserver reproducibility with different histologic criteria used in celiac disease». Clin. Gastroenterol. Hepatol. 5 (7): 838–43. PMID 17544877. doi:10.1016/j.cgh.2007.03.019 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Jores RD, Frau F, Cucca F, Grazia Clemente M, Orrù S, Rais M, De Virgiliis S, Congia M (2007). «HLA-DQB1*0201 homozygosis predisposes to severe intestinal damage in celiac disease». Scand. J. Gastroenterol. 42 (1): 48–53. PMID 17190762. doi:10.1080/00365520600789859 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Karell K, Louka AS, Moodie SJ, Ascher H, Clot F, Greco L, Ciclitira PJ, Sollid LM, Partanen J (2003). «HLA types in celiac disease patients not carrying the DQA1*05-DQB1*02 (DQ2) heterodimer: results from the European Genetics Cluster on Celiac Disease». Hum. Immunol. 64 (4): 469–77. PMID 12651074. doi:10.1016/S0198-8859(03)00027-2 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Michalski JP, McCombs CC, Arai T, Elston RC, Cao T, McCarthy CF, Stevens FM (1996). «HLA-DR, DQ genotypes of celiac disease patients and healthy subjects from the West of Ireland». Tissue Antigens. 47 (2): 127–33. PMID 8851726. doi:10.1111/j.1399-0039.1996.tb02525.x !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Kaur G, Sarkar N, Bhatnagar S, Kumar S, Rapthap CC, Bhan MK, Mehra NK (2002). «Pediatric celiac disease in India is associated with multiple DR3-DQ2 haplotypes». Hum. Immunol. 63 (8): 677–82. PMID 12121676. doi:10.1016/S0198-8859(02)00413-5 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Layrisse Z, Guedez Y, Domínguez E, Paz N, Montagnani S, Matos M, Herrera F, Ogando V, Balbas O, Rodríguez-Larralde A (2001). «Extended HLA haplotypes in a Carib Amerindian population: the Yucpa of the Perija Range». Hum Immunol. 62 (9): 992–1000. PMID 11543901. doi:10.1016/S0198-8859(01)00297-X !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ ab Dubois PC, Trynka G, Franke L, Hunt KA, Romanos J, Curtotti A, Zhernakova A, Heap GA, Adány R, Aromaa A, Bardella MT, van den Berg LH, Bockett NA, de la Concha EG, Dema B, Fehrmann RS, Fernández-Arquero M, Fiatal S, Grandone E, Green PM, Groen HJ, Gwilliam R, Houwen RH, Hunt SE, Kaukinen K, Kelleher D, Korponay-Szabo I, Kurppa K, MacMathuna P, Mäki M, Mazzilli MC, McCann OT, Mearin ML, Mein CA, Mirza MM, Mistry V, Mora B, Morley KI, Mulder CJ, Murray JA, Núñez C, Oosterom E, Ophoff RA, Polanco I, Peltonen L, Platteel M, Rybak A, Salomaa V, Schweizer JJ, Sperandeo MP, Tack GJ, Turner G, Veldink JH, Verbeek WH, Weersma RK, Wolters VM, Urcelay E, Cukrowska B, Greco L, Neuhausen SL, McManus R, Barisani D, Deloukas P, Barrett JC, Saavalainen P, Wijmenga C, van Heel DA (2010). «Multiple common variants for celiac disease influencing immune gene expression». Nature Genetics. 42 (4): 295–302. PMC 2847618 . PMID 20190752. doi:10.1038/ng.543 !CS1 manut: Nomes múltiplos: lista de autores (link)
. PMID 20190752. doi:10.1038/ng.543 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Walcher, Dwain N. and Kretchmer, Norman (1981). Food, nutrition, and evolution: food as an environmental factor in the genesis of human variability. [S.l.]: Papers presented at the International Congress of the International Organization for the Study of Human Development, Masson Pub. pp. 179–199. ISBN 0-89352-158-2 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Catassi, Carlo (2005). «Where Is Celiac Disease Coming From and Why?». Journal of Pediatric Gastroenterology & Nutrition. 40 (3). 279 páginas. doi:10.1097/01.MPG.0000151650.03929.D5
↑ Zhernakova A, Elbers CC, Ferwerda B, Romanos J, Trynka G, Dubois PC, de Kovel CG, Franke L, Oosting M, Barisani D, Bardella MT, Joosten LA, Saavalainen P, van Heel DA, Catassi C, Netea MG, Wijmenga C (2010). «Evolutionary and functional analysis of celiac risk loci reveals SH2B3 as a protective factor against bacterial infection». American Journal of Human Genetics. 86 (6): 970–7. PMC 3032060 . PMID 20560212. doi:10.1016/j.ajhg.2010.05.004 !CS1 manut: Nomes múltiplos: lista de autores (link)
. PMID 20560212. doi:10.1016/j.ajhg.2010.05.004 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Green PH, Cellier C (2007). «Celiac disease». N. Engl. J. Med. 357 (17): 1731–43. PMID 17960014. doi:10.1056/NEJMra071600
↑ Lammers KM, Lu R, Brownley J, Lu B, Gerard C, Thomas K, Rallabhandi P, Shea-Donohue T, Tamiz A, Alkan S, Netzel-Arnett S, Antalis T, Vogel SN, Fasano A (2008). «Gliadin induces an increase in intestinal permeability and zonulin release by binding to the chemokine receptor CXCR3». Gastroenterology. 135 (1): 194–204.e3. PMC 2653457 . PMID 18485912. doi:10.1053/j.gastro.2008.03.023 !CS1 manut: Nomes múltiplos: lista de autores (link)
. PMID 18485912. doi:10.1053/j.gastro.2008.03.023 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Qiao SW, Bergseng E, Molberg Ø; et al. (Agosto de 2004). «Antigen presentation to celiac lesion-derived T cells of a 33-mer gliadin peptide naturally formed by gastrointestinal digestion». J. Immunol. 173 (3): 1757–62. PMID 15265905. doi:10.4049/jimmunol.173.3.1757 !CS1 manut: Uso explícito de et al. (link) !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Shan L, Qiao SW, Arentz-Hansen H, Molberg Ø, Gray GM, Sollid LM, Khosla C (2005). «Identification and analysis of multivalent proteolytically resistant peptides from gluten: implications for celiac sprue». J. Proteome Res. 4 (5): 1732–41. PMC 1343496 . PMID 16212427. doi:10.1021/pr050173t !CS1 manut: Nomes múltiplos: lista de autores (link)
. PMID 16212427. doi:10.1021/pr050173t !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Dieterich W, Ehnis T, Bauer M, Donner P, Volta U, Riecken EO, Schuppan D (1997). «Identification of tissue transglutaminase as the autoantigen of celiac disease». Nat Med. 3 (7): 797–801. PMID 9212111. doi:10.1038/nm0797-797 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Skovbjerg H, Norén O, Anthonsen D, Moller J, Sjöström H (2002). «Gliadin is a good substrate of several transglutaminases: possible implication in the pathogenesis of coeliac disease». Scand J Gastroenterol. 37 (7): 812–7. PMID 12190095. doi:10.1080/713786534 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Fleckenstein B, Molberg Ø, Qiao SW, Schmid DG, von der Mülbe F, Elgstøen K, Jung G, Sollid LM (2002). «Gliadin T cell epitope selection by tissue transglutaminase in celiac disease. Role of enzyme specificity and pH influence on the transamidation versus deamidation process». J Biol Chem. 277 (37): 34109–34116. PMID 12093810. doi:10.1074/jbc.M204521200 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Koning F, Schuppan D, Cerf-Bensussan N, Sollid LM (Junho de 2005). «Pathomechanisms in celiac disease». Best practice & research. Clinical gastroenterology. 19 (3): 373–387. ISSN 1521-6918. PMID 15925843. doi:10.1016/j.bpg.2005.02.003 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Mowat AM (2003). «Coeliac disease – a meeting point for genetics, immunology, and protein chemistry». Lancet. 361 (9365): 1290–1292. PMID 12699968. doi:10.1016/S0140-6736(03)12989-3
↑ Dewar D, Pereira SP, Ciclitira PJ (2004). «The pathogenesis of coeliac disease». Int J Biochem Cell Biol. 36 (1): 17–24. PMID 14592529. doi:10.1016/S1357-2725(03)00239-5 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Kaukinen K, Peräaho M, Collin P, Partanen J, Woolley N, Kaartinen T, Nuutinen T, Halttunen T, Mäki M, Korponay-Szabo I (2005). «Small-bowel mucosal tranglutaminase 2-specific IgA deposits in coeliac disease without villous atrophy: A Prospective and radmonized clinical study». Scand J Gastroenterology. 40 (5): 564–572. PMID 16036509. doi:10.1080/00365520510023422 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Salmi TT, Collin P, Korponay-Szabó IR, Laurila K, Partanen J, Huhtala H, Király R, Lorand L, Reunala T, Mäki M, Kaukinen K (2006). «Endomysial antibody-negative coeliac disease: clinical characteristics and intestinal autoantibody deposits». Gut. 55 (12): 1746–53. PMC 1856451 . PMID 16571636. doi:10.1136/gut.2005.071514 !CS1 manut: Nomes múltiplos: lista de autores (link)
. PMID 16571636. doi:10.1136/gut.2005.071514 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Londei M, Ciacci C, Ricciardelli I, Vacca L, Quaratino S, Maiuri L (2005). «Gliadin as a stimulator of innate responses in celiac disease». Mol Immunol. 42 (8): 913–918. PMID 15829281. doi:10.1016/j.molimm.2004.12.005 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Zanoni G, Navone R, Lunardi C, Tridente G, Bason C, Sivori S, Beri R, Dolcino M, Valletta E, Corrocher R, Puccetti A (2006). «In celiac disease, a subset of autoantibodies against transglutaminase binds toll-like receptor 4 and induces activation of monocytes». PLoS Med. 3 (9): e358. PMC 1569884 . PMID 16984219. doi:10.1371/journal.pmed.0030358 !CS1 manut: Nomes múltiplos: lista de autores (link)
. PMID 16984219. doi:10.1371/journal.pmed.0030358 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Salim AF, Phillips AD, Farthing MJ (1990). «Pathogenesis of gut virus infection». Baillieres Clin Gastroenterol. 4 (3): 593–607. PMID 1962725. doi:10.1016/0950-3528(90)90051-H !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ National Institute for Health and Clinical Excellence. Clinical guideline 53: Chronic fatigue syndrome/myalgic encephalomyelitis. Londres, 2007.
↑ National Institute for Health and Clinical Excellence. Clinical guideline 15: Diagnosis and management of type 1 diabetes in children, young people and adults. Londres, 2004.
↑ Spersud, Erik e Jennifer (2008). Everything You Want To Know About Recipes And Restaurants And Much More. Estados Unidos: Authorhouse. p. 172. ISBN 978-1-4343-6034-2. doi:10.1007/b62130
↑ Treem WR (2004). «Emerging concepts in celiac disease». Curr Opin Pediatr. 16 (5): 552–9. PMID 15367850. doi:10.1097/01.mop.0000142347.74135.73
↑ Lee AR, Ng DL, Zivin J, Green PH (2007). «Economic burden of a gluten-free diet». J Hum Nutr Diet. 20 (5): 423–30. PMID 17845376. doi:10.1111/j.1365-277X.2007.00763.x !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Troncone R, Ivarsson A, Szajewska H, Mearin ML (2008). «Review article: future research on coeliac disease – a position report from the European multistakeholder platform on coeliac disease (CDEUSSA)». Aliment. Pharmacol. Ther. 27 (11): 1030–43. PMID 18315588. doi:10.1111/j.1365-2036.2008.03668.x !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ ab Akobeng AK, Thomas AG (Junho de 2008). «Systematic review: tolerable amount of gluten for people with coeliac disease». Aliment. Pharmacol. Ther. 27 (11): 1044–52. PMID 18315587. doi:10.1111/j.1365-2036.2008.03669.x
↑ «Foods for people intolerant to gluten (gluten-free foods)». Directorate-General for Health and Consumers. Consultado em 4 de março de 2014
↑ Food and Drug Administration (2 de agosto de 2013). «What is Gluten-Free? FDA Has an Answer». Consultado em 2 de agosto de 2013
↑ FAO/WHO. «Current Official Standards». Cópia arquivada em 4 de junho de 2011
↑ Häuser W, Stallmach A, Caspary WF, Stein J (Março de 2007). «Predictors of reduced health-related quality of life in adults with coeliac disease». Aliment. Pharmacol. Ther. 25 (5): 569–78. PMID 17305757. doi:10.1111/j.1365-2036.2006.03227.x !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Goddard CJ, Gillett HR (Novembro de 2006). «Complications of coeliac disease: are all patients at risk?». Postgrad Med J. 82 (973): 705–12. PMC 2660494 . PMID 17099088. doi:10.1136/pgmj.2006.048876
. PMID 17099088. doi:10.1136/pgmj.2006.048876
↑ Häuser W, Gold J, Stein J, Caspary WF, Stallmach A (Julho de 2006). «Health-related quality of life in adult coeliac disease in Germany: results of a national survey». Eur J Gastroenterol Hepatol. 18 (7): 747–54. PMID 16772832. doi:10.1097/01.meg.0000221855.19201.e8 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ ab Barker JM, Liu E (2008). «Celiac disease: pathophysiology, clinical manifestations, and associated autoimmune conditions». Adv Pediatr. 55: 349–65. PMC 2775561 . PMID 19048738. doi:10.1016/j.yapd.2008.07.001
. PMID 19048738. doi:10.1016/j.yapd.2008.07.001
↑ Leeds JS, Hopper AD, Sanders DS (2008). «Coeliac disease». Br Med Bull. 88 (1): 157–70. PMID 19073695. doi:10.1093/bmb/ldn044 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Houlston RS, Ford D (1996). «Genetics of coeliac disease». QJM. 89 (10): 737–43. PMID 8944229. doi:10.1093/qjmed/89.10.737
↑ Buchanan N (1987). Child and Adolescent Health for Practitioners. [S.l.]: Williams & Wilkins. 164 páginas. ISBN 0-86433-015-4
↑ Zipser RD, Farid M, Baisch D, Patel B, Patel D (2005). «Physician awareness of celiac disease: a need for further education». J Gen Intern Med. 20 (7): 644–6. PMC 1490146 . PMID 16050861. doi:10.1007/s11606-005-0111-7 !CS1 manut: Nomes múltiplos: lista de autores (link)
. PMID 16050861. doi:10.1007/s11606-005-0111-7 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Hischenhuber C, Crevel R, Jarry B, Mäki M, Moneret-Vautrin DA, Romano A, Troncone R, Ward R (Março de 2006). «Review article: safe amounts of gluten for patients with wheat allergy or coeliac disease». Aliment. Pharmacol. Ther. 23 (5): 559–75. PMID 16480395. doi:10.1111/j.1365-2036.2006.02768.x !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ «Statement by the National Conference of Catholic bishops on the use of low gluten hosts at Mass». BCL Newsletter. Novembro de 2003
↑ Adams, Scott (2 de agosto de 2002). «Bishops in Italy Approve a German-made Low Gluten Eucharistic Host». Celiac.com
↑ Associated Press (8 de dezembro de 2004). «Girl with digestive disease denied Communion». MSNBC. Consultado em 30 de maio de 2006
↑ McNamara, Edward (15 de setembro de 2004). «Liturgy: Gluten-free Hosts». Catholic Online. Consultado em 17 de junho de 2007
↑ Joseph Ratzinger (24 de julho de 2003). Prot. 89/78-174 98. Congregação para a Doutrina da Fé. Texto completo em: «The Use of Mustum and Low-Gluten Hosts at Mass». BCL Newsletter. Novembro de 2003. Consultado em 7 de março de 2007
↑ Rabbi Avraham Juravel. «Gluten Intolerance, Celiac, Allergies And Pesach». Orthodox Union. Consultado em 3 de setembro de 2006. Cópia arquivada em 12 de outubro de 2007
↑ Gee, SJ (1888). «On the coeliac affection». St Bartholomew's Hospital Report. 24: 17–20
↑ Herter, CA (1908). On infantilism from chronic intestinal infection; characterized by the overgrowth and persistence of flora in the nursing period. Nova Iorque: Macmillan & Co
↑ Haas SV (1924). «The value of the banana in the treatment of coeliac disease». Am J Dis Child. 24 (4): 421–37. doi:10.1001/archpedi.1924.04120220017004
↑ van Berge-Henegouwen GP, Mulder CJ (1993). «Pioneer in the gluten free diet: Willem-Karel Dicke 1905–1962, over 50 years of gluten free diet». Gut. 34 (11): 1473–5. PMC 1374403 . PMID 8244125. doi:10.1136/gut.34.11.1473
. PMID 8244125. doi:10.1136/gut.34.11.1473
↑ Dicke WK (1950). Coeliakie: een onderzoek naar de nadelige invloed van sommige graansoorten op de lijder aan coeliakie. Utrecht, Países Baixos: Universidade de Utrecht
↑ Fasano A (2009). «Celiac Disease Insights: Clues to Solving Autoimmunity». Scientific American (Agosto): 49–57
↑ Anderson CM, French JM, Sammons HG, Frazer AC, Gerrard JW, Smellie JM (1952). «Coeliac disease; gastrointestinal studies and the effect of dietary wheat flour». Lancet. 1 (17): 836–42. PMID 14918439. doi:10.1016/S0140-6736(52)90795-2 !CS1 manut: Nomes múltiplos: lista de autores (link)
↑ Paulley JW (1954). «Observation on the aetiology of idiopathic steatorrhoea; jejunal and lymph-node biopsies». Br Med J. 2 (4900): 1318–21. PMC 2080246 . PMID 13209109. doi:10.1136/bmj.2.4900.1318
. PMID 13209109. doi:10.1136/bmj.2.4900.1318
↑ Macdonald WC, Dobbins WO, Rubin CE (1965). «Studies of the familial nature of celiac sprue using biopsy of the small intestine». N Engl J Med. 272 (9): 448–56. PMID 14242522. doi:10.1056/NEJM196503042720903 !CS1 manut: Nomes múltiplos: lista de autores (link)
Ligações externas |
Federação das Associações de Celíacos do Brasil (em português)
Associação Portuguesa de Celíacos (em português)
Doença celíaca (em português) - diretriz prática da Organização Mundial de Gastroenterologia
- Este artigo foi inicialmente traduzido do artigo da Wikipédia em inglês, cujo título é «Coeliac disease».