Anilina
| Anilina Alerta sobre risco à saúde | |
|---|---|
 |  |
| Outros nomes | Fenilamina Aminobenzeno |
| Identificadores | |
Número CAS | |
SMILES |
|
| Propriedades | |
Fórmula molecular | C6H7N |
Massa molar | 93.126 g/mol |
| Aparência | líquido incolor |
Densidade | 1.0217 g/ml, líquido |
Ponto de fusão | −6.3 °C |
Ponto de ebulição | 184.13 °C |
Solubilidade em água | 3.6 g/100 mL at 20°C |
Basicidade (pKb) | 9.40 |
Viscosidade | 3.71 cP at 25 °C |
| Termoquímica | |
Entalpia padrão de combustão ΔcH | -3394 kJ/mol |
| Riscos associados | |
Classificação UE | Tóxico (T) Carc. Cat. 3 Muta. Cat. 3 Perigoso para o ambiente (N) |
NFPA 704 |  2 3 0 |
Frases R | R23/24/25, R40, R41, R43, R48/23/24/25, R68, R50 |
Frases S | S1/2, S26, S27, S36/37/39 S45, S46 , S61, S63 |
| Compostos relacionados | |
| Outros aniões/ânions | Fenol Fenilidrazina Nitrosobenzeno Nitrobenzeno Fenilidroxilamina (N-fenil-hidroxilamina) |
Aminas aromáticas relacionados | 1-Naftilamina 2-Naftilamina Diaminobenzeno 4-Aminobifenil N-Metilanilina Toluidina (2,3 ou 4-Metilanilina) Difenilamina |
| Compostos relacionados | Benzeno Amoníaco Ácido 4-aminobenzóico 2-Nitroanilina 3-Nitroanilina 4-Nitroanilina Ácido sulfanílico Ciclohexilamina Aminofenol |
Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Anilina, fenilamina ou aminobenzeno é um composto orgânico, líquido, incolor e ligeiramente amarelo de odor característico, que como muitas aminas aromáticas, e um sabor aromático cáustico. Não se evapora facilmente a temperatura ambiente, sendo facilmente inflamável, queimando com uma chama fumacenta. A anilina é levemente solúvel em água e se dissolve facilmente na maioria dos solventes orgânicos e inorgânicos.
Índice
1 Aplicações
2 Estrutura e síntese
2.1 Derivados
3 Propriedades
3.1 Oxidação
3.2 Basicidade
3.3 Acilação
3.4 Derivados de N-alquila
3.5 Derivados de enxofre
3.6 Diazotização
3.7 Outras reações
4 Toxicologia
5 Referências
6 Ver também
Aplicações |
A anilina é usada para fabricar uma ampla variedade produtos como por exemplo a espuma de poliuretano, produtos químicos agrícolas, pinturas sintéticas, antioxidantes, estabilizadores para a indústria do látex, herbicidas e vernizes e explosivos e também na fabricação de camisinhas masculinas e femininas.
É usada, entre diversas outras funções, como matéria prima para inúmeros corantes, advindo daí, exatamente, o uso até errôneo deste termo como sinônimo de corante.
Estrutura e síntese |
Consistindo de um grupo fenila ligado a um grupo amino, a anilina é normalmente produzida industrialmente em dois passos do benzeno:
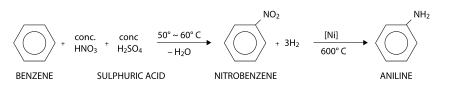
Primeiro, benzeno é nitrado usando uma mistura concentrada de ácido nítrico e ácido sulfúrico a 50 a 60 °C, o qual resulta em nitrobenzeno. No segundo passo, o nitrobenzeno é hidrogenado, tipicamente a 600 °C em presença de um catalisador de níquel para resultando na anilina. Como alternativa, anilina é também preparada do fenol e amônia, o fenol sendo derivado do cumeno.[1]
Derivados |
Muitos derivados de anilina podem ser preparados de maneira similar. No comércio, três tipos de anilina são distinguidas - óleo de anilina para azul, o qual é anilina tecnicamente pura; óleo de anilina para vermelho, uma mistura de quantidades equimolares de anilina e orto- e para-toluidina; e óleo de anilina para safranina, a qual contém anilina e orto-toluidina, e é obtida pela destilação da fusão (escórias) da fucsina.
Propriedades |
Oxidação |
Anilina é incolor, ela lentamente oxida-se ao ar, resultando numa coloração castanho-avermelhada em amostras envelhecidas. A oxidação da anilina tem sido cuidadosamente investigada. Em solução alcalina, azobenzeno resulta, enquanto ácido arsênico produz a coloração violeta da chamada violanilina. Ácido crômico a converte em quinona, enquanto cloratos, na presença de certos sais metálicos, especialmente do vanádio), dando negro de anilina. Ácido clorídrico e clorato de potássio dão cloranil. Permanganato de potássio em solução neutra oxida-a em nitrobenzeno, em solução alcalina a azobenzeno, amônia e ácido oxálico, em solução ácida a negro de anilina. Ácido hipocloroso dá 4-aminofenol e para-amino-difenilamina.
Basicidade |
Anilina é uma base fraca. Aminas aromáticas tais como a anilina são, em geral, bases muito mais fracas que aminas alifáticas. Anilina reage com ácidos fortes formando íon anilinium (ou anilínio, fenilamonium, fenilamônio) (C6H5-NH3+). O sulfato forma cristais em forma de belas placas brancas. Embora anilina seja fracamente básica, ela precipita sais de zinco, alumínio, e sais férricos, e, sob aquecimento, expele amônia de seus sais. A fraca basicidade é devido a um efeito indutivo negativo como o par solitário de elétrons no nitrogênio ser parcialmente deslocalizado no sistema pi do anel benzênico.
Acilação |
Anilina reage com ácidos carboxílicos[2] ou mais facilmente com cloretos de acila tais como cloreto de acetila resultando em amidas. As amidas formadas de anilina são algumas vezes chamadas anilidas, por exemplo CH3-CO-NH-C6H5 é chamada de acetanilida. Antifebrina (acetanilida), um antipirético e analgésico, é obtido pela reação de ácido acético e anilina.
Derivados de N-alquila |
Anilina combina-se diretamente com iodetos de alquila para formar aminas secundárias e terciárias. Metil e dimetilanilina são líquidos incolores preparados por aquecimento de anilina, cloridrato de anilina e metanol em um autoclave a 220 °C. Elas são de grande importância na indústria de corantes, assim como também, na produção de corantes específicos, a N,N-dietilanilina. Metilanilina ebule a 193-195 °C, dimetilanilina a 192 °C.
Derivados de enxofre |
Por ebulição com dissulfeto de carbono, dá sulfocarbanilida (difenil tioureia), CS(NHC6H5)2, a qual pode ser decomposta em fenil isotiocianato, C6H5CNS, e trifenil guanidina, C6H5N=C(NHC6H5)2.
Como fenóis, derivados de anilina são altamente suscetíveis a reações de substituição eletrofílica. Por exemplo, a reação de anilina com ácido sulfúrico a 180 °C produz ácido sulfanílico, NH2C6H4SO3H, o qual pode ser convertido a sulfanilamida. Sulfanilamida é uma das sulfonamidas ou "sulfas" que foram largamente usadas como antibacterianos no início do século XX.
Diazotização |
Por meio da diazotização ou reações de transferência de grupo diazo, a anilina e seus derivados substituídos no anel reagem com ácido nitroso formando sais de diazônio. Através deles, o grupo -NH2 da anilina pode ser convenientemente convertido a -OH, -CN, ou um haleto via a as reações de Sandmeyer. É uma importante reação na produção de compostos chamados azo-compostos, incluindo muitos corantes, por sua vez, chamados corantes azóicos.
Outras reações |
Anilina reage com nitrobenzeno produzindo fenazina na reação de Wohl-Aue.
Seu acetato é usado no teste do acetato de anilina para carboidratos, identificando pentoses por conversão a furfural.
Toxicologia |
A DL50 em ratos é de 440 mg/kg. Tem absorção tanto dérmica, como oral e pulmonar.
Referências
↑ Thomas Kahl, Kai-Wilfrid Schröder, "Aniline"; Ullmann's Encyclopedia of Industrial Chemistry 2007; John Wiley & Sons: New York.
↑ Carl N. Webb (1941). «Benzanilide». Org. Synth. ; Coll. Vol., 1
Ver também |
- Meta-hemoglobinemia ou metemoglobinemia
- Nitrobenzeno
- Dimetilanilina
- Dinitrobenzeno
- Dinitrotolueno